Lý thuyết: Nguyên tố và đơn chất Halogen
I. Giới thiệu về nguyên tố nhóm VIIA
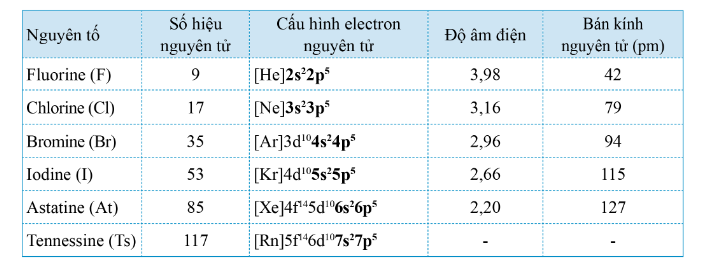
Các nguyên tố nhóm VIIA gồm:
+ Fluorine: F
+ Chlorine: Cl
+ Bromine: Br
+ Iodine: I
+ Astatine: At
+ Tennessine: Ts

- 4 nguyên tố F, Cl, Br, I tồn tại trong tự nhiên còn At và Ts là nguyên tố phóng xạ
Một số đặc điểm của các nguyên tố Halogen:
- Các nguyên tử halogen có 7 electron ở lớp ngoài cùng
=> Dễ nhận thêm 1 electron
ns2np5 + 1e → ns2np6
=> Số oxi hóa đặc trăng của halogen trong hợp chất là -1
Mỗi nguyên tử nguyên tố nhóm VIIA đều có 7 electron lớp ngoài cùng => phi kim
II. Đơn chất Halogen
Ở điều kiện thường, đơn chất Halogen tồn tại ở dạng phân tử hai nguyên tử, kí hiệu chung là X2
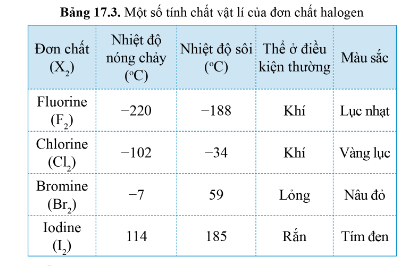
1. Xu hướng biến đổi một số tính chất vật lí
Một số tính chất vật lí của đơn chất Halogen:
Thể của các halogen ở điều kiện thường biến đổi từ khí (fluorine, chlorine) đến lỏng (bromine) và rắn (iodine)
2. Xu hướng tạo liên kết trong các phản ứng hóa học
Nguyên tố Halogen có 7 electron hóa trị => Halogen thường có 2 xu hướng tạo liên khi phản ứng hóa học với chất khác
* Xu hướng 1: Nhận thêm 1e từ nguyên tử khác
Ví dụ: Khi chlorine phản ứng với magnesium có sự nhận và nhường electron như sau:
Phương trình hóa học của phản ứng là:
* Xu hướng 2: Góp chung e hóa trị với nguyên tử nguyên tố khác
Ví dụ:
Trong phản ứng giữa chlorine và hydrogen, nguyên tử của mỗi chất sẽ góp chung 1 electron độc thân để hình thành một liên kết cộng hóa trị.
Phương trình hóa học của phản ứng:
=> Nhóm Halogen có tính phi kim mạnh hơn các nhóm phi kim còn lại trong Bảng tuần hoàn
Hóa trị phổ biến của các Halogen là 1
3. Xu hướng thể hiện tính oxi hóa
a) Phản ứng với hydrogen
Các đơn chất halogen đều phản ứng với hydrogen tạo hydrogen halide nhưng ở các điều kiện phản ứng khác nhau
b) Phản ứng thế Halogen
Trong dung dịch, các halogen có tính oxi hóa mạnh hơn sẽ phản ứng với muối halide của halogen có tính oxi hóa yếu hơn để tạo ra các halogen có tính oxi hóa yếu hơn.
c) Phản ứng với nước, với dung dịch sodium hydroxide
Các halogen(trừ fluorine) tác dụng được với nước hoặc dung dịch sodium hydroxide thể hiện cả tính oxi hóa và khử.
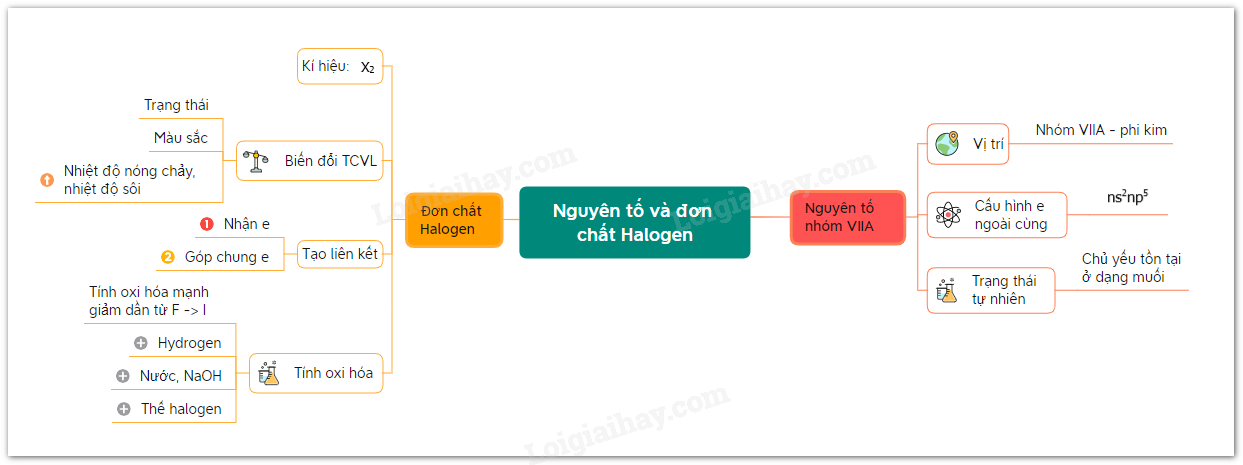
Sơ đồ tư duy